2.1 แบบจำลองอะตอม
2.1.1 แบบจำลองอะตอมของดอลตัน
ในปีพ.ศ 2346 จอห์นดอลตัน นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอมเพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงของมวลของสารก่อนและหลังทำปฏิกิริยาเคมีรวมทั้งอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบหนึ่งหนึ่งซึ่งมีสาระสำคัญดังนี้
1.ประกอบด้วยอนุภาคขนาดเล็กๆเหล่านี้เรียกว่าอะตอมซึ่งแบ่งแยกและทำให้สูญหายไม่ ได้
2.อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกันเช่นมีมวลเท่าแต่จะมีสมบัติแตกต่างจาก อะตอมของธาตุอื่น
3.สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยาเคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อยๆ
2.อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกันเช่นมีมวลเท่าแต่จะมีสมบัติแตกต่างจาก อะตอมของธาตุอื่น
3.สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยาเคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อยๆ
ทฤษฎีอะตอมของดอลตันช่วยให้นักวิทยาศาสตร์ในสมัยนั้นสามารถอธิบายลักษณะและสมบัติของอะตอมได้เพียงระดับหนึ่งต่อมาได้มีการศึกษาเกี่ยวกับอะตอมเพิ่มขึ้นและค้นพบว่ามีข้อมูลแบบประกันไม่สอดคล้องกับแนวคิดของดอลตัน เช่นคำว่าต่อมของธาตุชนิดเดียวกันมีมวลแตกต่างกันได้อะตอมสามารถแบ่งแยกได้อีกแนวคิดเกี่ยวกับทฤษฎีอะตอมของดอลตันจึงไม่ถูกต้อง
2.1.2 แบบจําลองอะตอมของทอมสัน
นักวิทยาศาสตร์หลายคนได้ศึกษาการนำไฟฟ้าของแก๊สโดยทดลองเกี่ยวกับผลของการใช้ความต่างศักย์ไฟฟ้าสูงต่อกับการเคลื่อนที่ของประจุไฟฟ้าของอะตอมแก๊สเพื่อให้ได้ข้อมูลที่ให้รายละเอียดเกี่ยวกับโครงสร้างภายในอะตอมโดยผ่านกระแสไฟฟ้าตรงเข้าไปในหลอดแก้วบรรจุแก๊สความดันต่ำซึ่งที่ภาวะนี้มีจำนวนอะตอมของแก๊สไม่หนาแน่นประจุไฟฟ้าสามารถเดินทางผ่านได้ไกลและพบว่าเมื่อเพิ่มความต่างศักย์ระหว่างขั้วไฟฟ้าให้สูงขึ้นจะมีกระแสไฟฟ้าไหลผ่านตลอด ขณะเดียวกันจะมีรังสีออกจากแคโทดไปยังแอโนดรังสีนี้เรียกว่ารังสีแคโทดเรียกหลอดแก้วชนิดนี้ว่าหลอดรังสีแคโทด
นักวิทยาศาสตร์หลายคนได้ศึกษาการนำไฟฟ้าของแก๊สโดยทดลองเกี่ยวกับผลของการใช้ความต่างศักย์ไฟฟ้าสูงต่อกับการเคลื่อนที่ของประจุไฟฟ้าของอะตอมแก๊สเพื่อให้ได้ข้อมูลที่ให้รายละเอียดเกี่ยวกับโครงสร้างภายในอะตอมโดยผ่านกระแสไฟฟ้าตรงเข้าไปในหลอดแก้วบรรจุแก๊สความดันต่ำซึ่งที่ภาวะนี้มีจำนวนอะตอมของแก๊สไม่หนาแน่นประจุไฟฟ้าสามารถเดินทางผ่านได้ไกลและพบว่าเมื่อเพิ่มความต่างศักย์ระหว่างขั้วไฟฟ้าให้สูงขึ้นจะมีกระแสไฟฟ้าไหลผ่านตลอด ขณะเดียวกันจะมีรังสีออกจากแคโทดไปยังแอโนดรังสีนี้เรียกว่ารังสีแคโทดเรียกหลอดแก้วชนิดนี้ว่าหลอดรังสีแคโทด
หลอดรังสีแคโทด
เป็นเครื่องที่ใช่ทดลองเกี่ยวกับการนำไฟฟ้าโดยหลอดรังสีแคโทดจะมีความดันต่ำมาก และความต่างศักย์สูงมาก วิลเลียม ครูกส์ได้สร้างหลอดรังสีแคโทดขึ้นมาโดยใช้แผ่นโลหะ 2 แผ่นเป็นขั้วไฟฟ้า โดยต่อขั้วไฟฟ้าลบกับขั้วลบของเครื่องกำเนิดไฟฟ้าเรียกว่า แคโทด และต่อขั้วไฟฟ้าบวกเข้ากับขั้วบวกของเครื่องกำเนิดไฟฟ้าเรียกว่า แอโนด
การค้นพบอิเล็กตรอน
เซอร์โจเซฟ จอห์น ทอมสัน ดัดแปลงหลอดรังสีใหม่รังสีพุ่งจากด้าแคโทดไปยังด้านแอโนด และจะมีรังสีส่วนหนึ่งทะลุออกไปกระทบกับฉากเรืองแสง หลังจากนั้นทอมสันได้เพิ่มขั้วไฟฟ้าเข้าไปในหลอดรังสีแคโทด พบว่าแนวการเคลื่อนที่เบนไปจากเดิมโดยเบนเข้าหาขั้วบวกของสนามไฟฟ้าเนื่องจากรังสีแคโทดเบนเข้าหาขั้วบวกของสนามไฟฟ้าจึงสรุปได้ว่า รังสีแคโทดประกอบด้วยอนุภาค ที่มีประจุไฟฟ้าลบ จากข้อมูลการทดลองร่วมกับทฤษฎีทางแม่เหล็กไฟฟ้าทำให้ทอมสันนำมาใช้คำนวณอัตราส่วนของประจุต่อมวลของรังสีแคโทดได้ทอมสันได้ทดลองเพื่อศึกษาอัตราส่วนของประจุต่อมวลของรังสีแคโทดซ้ำหลายครั้งโดยเปลี่ยนชนิดของแก๊สและชนิดของโลหะที่ใช้ทำเป็นขั้วแคโทดปรากฏว่าอัตราส่วนของประจุต่อมวลของรังสีแคโทดมีค่าโดยประมาณเท่ากันคือ 1.76
× 10^8 คูลอมบ์/กรัมจึงสรุปได้ว่าอนุภาครังสีแคโทดที่ออกมาจากโลหะต่างชนิดกันเป็นอนุภาคเดียวกันซึ่งต่อมาได้ด้วยอนุภาคนี้ว่า อิเล็กตรอน
การค้นพบโปรตอน
เนื่องจากอะตอมเป็นกลางทางไฟฟ้า และการที่พบว่าอะตอมของธาตุทุกชนิดประกอบด้วยอิเล็กตรอนซึ่งมีประจุไฟฟ้าเป็นลบ ทำให้นักวิทยาศาสตร์เชื่อว่าองค์ประกอบอีกส่วนหนึ่งของอะตอม จะต้องมีประจุบวกด้วย ออยแกน โกลด์สไตน์ (Eugen Goldstein) นักวิทยาศาสตร์ชาวเยอรมัน ได้ทดลองเกี่ยวกับหลอดรังสีแคโทด โดยดัดแปลงหลอดรังสีแคโทด ดังรูป
ผลการทดลองของโกสไตน์
เมื่อผ่านกระแสไฟฟ้า ปรากฏว่ามีจุดสว่างเกิดขึ้นทั้งฉากเรืองแสง ก. และฉากเรืองแสง ข.
โกลสไตน์ได้อธิบายว่า จุดเรืองแสงที่เกิดขึ้นบนฉากเรืองแสง ก. จะต้องเกิดจากที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวก เคลื่อนที่ผ่านรูตรงกลางของแคโทด ไปยังฉากเรืองแสง แต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซ หรือเกิดจากอะตอมของขั้วไฟฟ้า และมีลักษณะเหมือนกันหรือไม่
โกลสไตน์ได้ทดลองเปลี่ยนชนิดของก๊าซในหลอดแก้วปรากฏว่าอนุภาคที่มีประจุไฟฟ้าบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่เท่ากัน ขึ้นอยู่กับชนิดของก๊าซที่ใช้และเมื่อทดลองเปลี่ยนโลหะที่ใช้ทำเป็นขั้วไฟฟ้าหลายๆชนิดแต่ให้ก๊าซในหลอดแก้วชนิดเดียวกัน ปรากฏว่า ผลการทดลองได้อัตราส่วนประจุต่อมวลเท่ากันแสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากก๊าซไม่ได้เกิดจากขั้วไฟฟ้า
สรุปแบบจำลองของทอมสัน
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้ อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ
2.1.3 แบบจำลองของรัทเทอร์ฟอร์ด
เมื่อปีพ.ศ 2454 รัทเทอร์ฟอร์ดนักวิทยาศาสตร์ชาวอังกฤษ และ ฮันส์ ไกเกอร์ นักวิทยาศาสตร์ ชาวเยอรมัน ได้ที่สุดแบบจำลองของอะตอมของทอมสันโดยการยิงอนุภาคแอลฟาไปยังแผ่นทองคำบางๆ
ผลการทดลองของรัทเทอร์ฟอร์ด ไม่สามารถอธิบายได้ด้วยแบบจำลองอะตอมของทอมสันรัทเทอร์ฟอร์ดอธิบายลักษณะภายในอะตอมว่าการที่รังสีแอลฟาส่วนใหญ่ผ่านแผ่นทองคำไปได้แสดงว่าภายในแผ่นทองคำต้องมีที่ว่างอยู่เป็นบริเวณกว้างการที่รังสีแอลฟาบางอนุภาคเบี่ยงเบนหรือสะท้อนกลับมาบริเวณด้านในของฉากเรืองแสงแสดงว่าภายในอะตอมน่าจะมีกลุ่มอนุภาคที่มีขนาดเล็กมากมีมวลสูงมากกว่ารังสีแอลฟาและมีประจุบวกและทดสอบจึงได้เสนอแบบจำลองใหม่ว่าอะตอมประกอบด้วยนิวเคลียสที่มีขนาดเล็กอยู่ภายในและมีประจุไฟฟ้าโดยมีอิเล็กตรอนเคลื่อนที่อยู่รอบรอบ
เมื่อปีพ.ศ 2454 รัทเทอร์ฟอร์ดนักวิทยาศาสตร์ชาวอังกฤษ และ ฮันส์ ไกเกอร์ นักวิทยาศาสตร์ ชาวเยอรมัน ได้ที่สุดแบบจำลองของอะตอมของทอมสันโดยการยิงอนุภาคแอลฟาไปยังแผ่นทองคำบางๆ
ผลการทดลองของรัทเทอร์ฟอร์ด ไม่สามารถอธิบายได้ด้วยแบบจำลองอะตอมของทอมสันรัทเทอร์ฟอร์ดอธิบายลักษณะภายในอะตอมว่าการที่รังสีแอลฟาส่วนใหญ่ผ่านแผ่นทองคำไปได้แสดงว่าภายในแผ่นทองคำต้องมีที่ว่างอยู่เป็นบริเวณกว้างการที่รังสีแอลฟาบางอนุภาคเบี่ยงเบนหรือสะท้อนกลับมาบริเวณด้านในของฉากเรืองแสงแสดงว่าภายในอะตอมน่าจะมีกลุ่มอนุภาคที่มีขนาดเล็กมากมีมวลสูงมากกว่ารังสีแอลฟาและมีประจุบวกและทดสอบจึงได้เสนอแบบจำลองใหม่ว่าอะตอมประกอบด้วยนิวเคลียสที่มีขนาดเล็กอยู่ภายในและมีประจุไฟฟ้าโดยมีอิเล็กตรอนเคลื่อนที่อยู่รอบรอบ
แบบจำลองอะตอมของรัทเทอร์ฟอร์ด ไม่ได้อธิบายว่าอิเล็กตรอนอยู่รอบนิวเคลียสในกามแนวคิดของรัทเทอร์ฟอร์ตจะพบว่ามวลส่วนใหญ่ของอะตอมคือมวลของนิวเคลียสส่วนอิเกตรอนถึงแม้จะเป็นส่วนประกอบที่ทำให้อะตอมมีขนาดใหญ่แต่มีมวลน้อยมากจนถือว่าไม่มีผลต่อมวล.
แบบจำลองอะตอมของรัทเทอร์ฟอร์ดไม่ได้อธิบายว่าอิเล็กตรอนอยู่รอบนิวเคลียสในลักษณะใดนักวิทยาศาสตร์จึงได้ทำการทดลองเพื่อรวบรวมข้อมูลเพิ่มเติมเกี่ยวกับตำแหน่งของอิเล็กตรอนเพื่อนำมาสร้างเป็นแบบจำลองที่มีความสมบูรณ์มากยิ่งขึ้น
2.1.4 แบบจำลองอะตอมของโบร์
สเปกตรัมแม่เหล็กไฟฟ้าประกอบด้วยคลื่นแม่เหล็กไฟฟ้าที่มีความยาวคลื่นต่างกันและมีความถี่ต่อเนื่องกันเป็นช่วงกว้างมีทั้งที่มองเห็นได้และมองเห็นไม่ได้มีชื่อเรียกต่างกันแสงที่ประสาทตาของมนุษย์สามารถรับรู้ได้เรียกว่าแสงที่ตามองเห็นมีความยาวคลื่นอยู่ในช่วง 400 ถึง 700 นาโนเมตร ซึ่งประกอบด้วยแสงสีต่างๆแต่ประสาทตาของมนุษย์ไม่สามารถแยกแสงที่มองเห็นเป็นสีต่างๆได้เองทำให้มองเห็นสีรวมกันซึ่งเรียกว่าแสงขาวและเมื่อแสงขาว ส่องผ่านปริซึม แสงขาวจะแยกออกเป็นแสงสีรุ้งต่อเนื่องกันเรียกว่าแถบสเปกตรัมของแสงขาว
มักซ์ พลังค์ นักวิทยาศาสตร์ ชาวเยอรมันได้ศึกษาพลังงานของคลื่นแม่เหล็กไฟฟ้าและได้ข้อสรุปเกี่ยวกับความสำคัญระหว่างพลังงานของคลื่นแม่เหล็กไฟฟ้ากับความถี่ของคลื่นนั้นว่าพลังงานของคลื่นแม่เหล็กไฟฟ้าจะแปรผันตามความถี่ของคลื่นและแปรผกผันกับความยาวของคลื่นดังความสัมพันธ์ต่อไปนี้
มักซ์ พลังค์ นักวิทยาศาสตร์ ชาวเยอรมันได้ศึกษาพลังงานของคลื่นแม่เหล็กไฟฟ้าและได้ข้อสรุปเกี่ยวกับความสำคัญระหว่างพลังงานของคลื่นแม่เหล็กไฟฟ้ากับความถี่ของคลื่นนั้นว่าพลังงานของคลื่นแม่เหล็กไฟฟ้าจะแปรผันตามความถี่ของคลื่นและแปรผกผันกับความยาวของคลื่นดังความสัมพันธ์ต่อไปนี้
E แปรผันตรงกับ vหรือ E = hv
เนื่องจาก E = c/แลมดาร์
ดังนั้น E = hc/แลมดาร์ช
เมื่อ E คือพลังงานของคลื่นแม่เหล็กไฟฟ้า มีหน่วยเป็นจูล
h คือค่าคงตัวของพลังค์ มีค่า 6.626
× 10^-34 จูลต่อวินาที
v คือความถี่ของคลื่นแม่เหล็กไฟฟ้า มีหน่วยเป็นเฮิรตซ์
c คือความเร็วของคลื่นแม่เหล็กไฟฟ้า เท่ากับ 3
× 10^8 เมตรต่อวินาที
จากการทดลองการใช้เกรตติงส่องดูแสงอาทิตย์และแสงจากหลอดฟลูออเรสเซนต์ สังเกตสิ่งที่ปรากฏแล้ว พบว่าสเปกตรัมจากแสงอาทิตย์มีสีต่อเนื่องกันเป็น แถบสเปกตรัม เส้นสเปกตรัมที่มองเห็นจากหลอดฟลูออเรสเซนต์ นอกจากจะมองเห็นเป็นแถบสเปกตรัมของสีชนิดต่างๆแล้วพื้นยังมีเส้นสีต่างๆปรากฏในแถบสเปกตรัมอีกด้วยและจากการสังเกตสเปกตรัมของไฮโดรเจนฮีเลียม นีออน และปรอท เพราะว่าถ้าแต่ละชนิดให้สเปกตรัมที่มีแสงสีต่างกันและมีจำนวน เส้นสีเฉพาะตัวเส้นสีนี้เรียกว่า เส้นสเปกตรัม
ธาตุต่างๆ เมื่อได้รับพลังงานจะเปล่งแสงเป็นสีต่างๆหลายสีเมื่อสีเหล่านั้นรวมกันแล้วจะสังเกตเห็นเป็นสีเดียวกันซึ่งทางเราไม่สามารถบอกความแตกต่างได้แต่เมื่อใช้แผ่นเกรตติงส่องดูจะเห็นเส้นสเปกตรัมของแต่ละธาตุที่มีลักษณะเฉพาะเช่นจำนวนสี จำนวนเส้น หรือตำแหน่งที่เกิดต่างกันไปการเกิดเส้นสเปกตรัมของธาตุอธิบายได้ว่าอิเล็กตรอนซึ่งเคลื่อนที่อยู่รอบบริเวณนิวเคลียสมีพลังงานเฉพาะตัวที่ต่ำหรือกล่าวได้ว่าอะตอมอยู่ใน สถานะพื้น เมื่ออะตอมได้รับ พลังงานเพิ่มขึ้นทำให้อิเล็กตรอนถูกกระตุ้นให้มีพลังงานสูงขึ้นหรือ อะตอมอยู่ใน สถานะกระตุ้น ที่สถานะอะตอมจะไม่เสถียรเนื่องจากมีพลังงานสูงอิเล็กตรอนจึงคายพลังงานออกมาส่วนหนึ่งทำให้อะตอมมีพลังงานลดลงและกลับเข้าสู่สภาพที่มีพลังงานต่ำลงเพื่อให้อะตอมมีความเสถียรมากขึ้นพลังงานส่วนใหญ่ที่ขายออกมาจะปรากฏในรูปพลังงานแสงและสามารถคำนวณได้โดยใช้ความสัมพันธ์ตามสมการของพลังค์ ซึ่งได้กล่าวไว้แล้วในข้างต้นถ้าแสงสีเหล่านี้แยกออกจากกันอย่างชัดเจนจะปรากฏเป็นเส้นสเปกตรัมแต่ถ้าแสงสีที่ปรากฏออกมามีลักษณะต่อเนื่องกันเป็นเส้นเดียวอย่างกับรุ้งหรือจากไส้หลอดไฟฟ้า ซึ่งเป็นโลหะร้อนและมีอะตอมอยู่กันอย่างหนาแน่นจะให้สเปกตรัมเป็นแถบสเปกตรัมซึ่งยากแก่การวิเคราะห์และแปลผลต่อภาวะอิเล็กตรอนที่มีพลังงานต่างๆเรียกว่า ระดับพลังงานของอิเล็กตรอน การเปลี่ยนแปลงพลังงาน ของอิเล็กตรอนระหว่างสถานะการ์ตูนและสถานะพื้นสามารถ อุปมานได้กับการกลิ้งลงบันไดของลูกบอลจากรูปจะเห็นว่าพลังงานศักย์หน้าบันไดแต่ละท่านมีค่าไม่เท่ากันโดยลูกบอลที่อยู่บันไดขั้นต่ำจะมีพลังงานศักย์ต่ำกว่าบันไดขั้นสูงและผลต่างของพลังงานระหว่างบันได 2 ขั้นมีค่าเฉพาะตัวที่แน่นอนโดยบันไดที่อยู่ห่างกันมากๆจะมีผลต่างของพลังงานมากกว่าบันไดที่อยู่ติดกัน
สรุปแบบจำลองอะตอมของนีลส์โบร์
1. อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นชั้นๆตามระดับพลังงานและแต่ละชั้นจะมีพลังงานเป็นค่าเฉพาะตัว อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกว่าระดับพลังงานต่ำสุด ยิ่งอยู่ห่างจากนิวเคลียสมากขึ้น ระดับพลังงานจะยิ่งสูงขึ้น
2.การเปลี่ยนแปลงระดับพลังงานของอิเล็กตรอนไม่จำเป็นต้องเปลี่ยนไประดับพลังงานที่อยู่ติดกันอาจมีการเปลี่ยนข้ามระดับพลังงานได้และจะอยู่ระหว่างระดับพลังงานไม่ได้
3.ผลต่างระหว่างพลังงานของระดับพลังงานต่ำจะมีค่ามากกว่าผลต่างของระดับพลังงานที่สูงขึ้นไป สร้างความรู้เรื่องการเปลี่ยนแปลงระดับพลังงานของอิเล็กตรอนและการเกิดสเปกตรัมช่วยให้โบร์นักวิทยาศาสตร์ชาวเดนมาร์ก สร้างแบบจำลองอะตอมเพื่อใช้อธิบายพฤติกรรมของอิเล็กตรอนในอะตอมดังกล่าวโดยกล่าวว่าอิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นวงกลมคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์แต่ละวงจะมีระดับพลังงานเฉพาะตัวระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสที่สุดมีระดับพลังงานต่ำที่สุดเรียกว่าระดับเขตและระดับพลังงานที่อยู่ถัดออกมาเรียกเป็น L
M N ... ตามลำดับ
อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกระดับพลังงาน
n = 1 ระดับพลังงานถัดไปเรียกระดับพลังงาน n =2 , n = 3,…….ตามลำดับ หรือเรียกเป็นชั้น K , L , M ,N ,O , P , Q ….
n = 1 ระดับพลังงานถัดไปเรียกระดับพลังงาน n =2 , n = 3,…….ตามลำดับ หรือเรียกเป็นชั้น K , L , M ,N ,O , P , Q ….
2.1.5 แบบจำลองอะตอมแบบกลุ่มหมอก
จากแบบจำลองอะตอมของโบร์ ไม่สามารถอธิบายสมบัติบางอย่างของธาตุที่มีหลายอิเล็กตรอนได้จึงมีการศึกษาเพิ่มเติมและเชื่อว่าอิเล็กตรอนมีสมบัติเป็นได้ทั้ง คลื่นและอนุภาคการศึกษาเพิ่มเติมและเชื่อว่า อิเล็กตรอนมีสมบัติเป็นได้ทั้ง คลื่นและอนุภาค
สรุปแบบจำลองอะตอมแบบกลุ่มหมอก
แบบจำลองนี้เชื่อว่า
1. อิเล็กตรอนไม่ได้เคลื่อนที่เป็นวงกลม แต่เคลื่อนที่ไปรอบๆนิวเคลียสเป็นรูปทรงต่างๆตามระดับพลังงาน
2. ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนได้ เนื่องจากอิเล็กตรอนมีขนาดเล็กมากและเคลื่อนที่รวดเร็วตลอดเวลาไปทั่วทั้งอะตอม
3. อะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเคลียส บริเวณที่มีหมอกทึบแสดงว่ามีโอกาสพบอิเล็กตรอนได้มากกว่าบริเวณที่มีหมอกจาง
1. อิเล็กตรอนไม่ได้เคลื่อนที่เป็นวงกลม แต่เคลื่อนที่ไปรอบๆนิวเคลียสเป็นรูปทรงต่างๆตามระดับพลังงาน
2. ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนได้ เนื่องจากอิเล็กตรอนมีขนาดเล็กมากและเคลื่อนที่รวดเร็วตลอดเวลาไปทั่วทั้งอะตอม
3. อะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเคลียส บริเวณที่มีหมอกทึบแสดงว่ามีโอกาสพบอิเล็กตรอนได้มากกว่าบริเวณที่มีหมอกจาง
2.2 อนุภาคในอะตอมและไอโซโทป
2.2.1 อนุภาคในอะตอม
ในปีพ.ศ 2451 โรเบิร์ตแอนดรูส์มิลลิแกน นักวิทยาศาสตร์ชาวอเมริกันได้ทำการหาค่าประจุของอิเล็กตรอนโดยการอาศัยสังเกตหยดน้ำมันในสนามไฟฟ้า
2.2.1 อนุภาคในอะตอม
ในปีพ.ศ 2451 โรเบิร์ตแอนดรูส์มิลลิแกน นักวิทยาศาสตร์ชาวอเมริกันได้ทำการหาค่าประจุของอิเล็กตรอนโดยการอาศัยสังเกตหยดน้ำมันในสนามไฟฟ้า
เมื่อไรน้ำมันที่ร่วงผ่านรูบนขั้วไฟฟ้าบวกกระทบรังสีจะมีประจุไฟฟ้าเกิดขึ้นทำให้ละอองน้ำมันบังหมดเคลื่อนที่เข้าหาขั้วไฟฟ้าบวกบางหยดเคลื่อนที่เข้าหาขั้วไฟฟ้าล็อคและปลดลอยนิ่งอยู่ระหว่างสนามไฟฟ้าขนาดของหยดน้ำมันที่ลอยนิ่งอยู่ระหว่างสนามไฟฟ้าสามารถสังเกตได้จากกล้องจุลทรรศน์และนำมาคำนวณหามวลของหยดน้ำมันที่สร้างความหนาแน่นของน้ำมันและจากความสำคัญของน้ำหนักของหยดน้ำมันที่ลอยนิ่งเท่ากับแรงที่เกิดจากสนามไฟฟ้าทำให้สามารถคำนวณค่าประจุไฟฟ้าบนหยดน้ำมันได้ ซึ่งพบว่าค่าประจุไฟฟ้าบนหยดน้ำมันมีค่าเป็นจำนวนเท่ากับ 1.60
× 10^-19 คูลอมบ์ มิลลิแกนจึงสรุปว่าประจุของอิเล็กตรอนมีค่าเท่ากับ 1.60
× 10^-19 คูลอมบ์ ไม่นำมาใช้คำนวณร่วมกับค่าประจุต่อมวลที่รายงานไว้โดยทอมสันจะได้หมดอิเล็กตรอนเท่ากับ 9.11
× 10^-28 กรัม
ในปีพ.ศ. 2429 ออยเกนโกลด์ ชไตน์ ได้ทำการดัดแปลงหลอดรังสีแคโทดโดยการสลับตำแหน่งของแคโทดแอโนดซึ่งเมื่อผ่านกระแสไฟฟ้าเข้าไปพบว่าจะเกิดการเรืองแสงแสดงว่ามีรังสีจากแอโนดซึ่ง เรียกรังสีนี้ว่ารังสีแคแนลหรือรังสีแอโนดซึ่งมีประจุบวก
ในปีพ.ศ. 2429 ออยเกนโกลด์ ชไตน์ ได้ทำการดัดแปลงหลอดรังสีแคโทดโดยการสลับตำแหน่งของแคโทดแอโนดซึ่งเมื่อผ่านกระแสไฟฟ้าเข้าไปพบว่าจะเกิดการเรืองแสงแสดงว่ามีรังสีจากแอโนดซึ่ง เรียกรังสีนี้ว่ารังสีแคแนลหรือรังสีแอโนดซึ่งมีประจุบวก
ออยเกนโกลด์ชไตน์ได้ทำการทดลองกับแก๊สหลายชนิดพบว่ารังสีเอกซ์มีค่าประจุต่อมวลไม่คงที่จนกระทั่งกลุ่มนักวิจัยนำทีมโดยรัฐศาสตร์และทอมสันได้ทำการศึกษาหล่อในลักษณะเดียวกันที่บรรจุแก๊สไฮโดรเจนทำให้ได้ข้อสรุปว่าอนุภาคบวกมีค่าประจุเท่ากับอิเล็กตรอนและหาค่ามวลของประจุได้เป็น 1.673 × 10^-24 กรัมซึ่งมากกว่ามวลอิเล็กตรอนประมาณ 1840 เท่าที่อนุภาคนี้ว่าโปรตอน
ในปีพศ 2475 เจมส์แชดวิก นักวิทยาศาสตร์ชาวอังกฤษได้ทดลองยิงอนุภาคแอลฟาเพลงอะตอมของธาตุต่างๆและทดสอบผลการทดลองด้วยเครื่องมือที่มีความเสี่ยงสูงทำให้ทราบว่าในนิวเคลียสมีอนุภาคที่เป็นกลางทางไฟฟ้าและเรียกว่านิวตรอนซึ่งมีมวลใกล้เคียงกับมวลของโปรตอนการค้นพบนิวตรอนช่วยอธิบายและสนับสนุนข้อมูลเกี่ยวกับมวลของอะตอมซึ่งคำว่ามีค่ามากกว่ามวลรวมของโปรตอนเสื้อผ้าคาร์บอนมีมวลของโปรตอนรวมกัน 6 หน่วยประมวลของอะตอมมีค่า 12 หน่วยและมวลของธาตุส่วนใหญ่มีค่าเป็น 2 เท่าหรือมากกว่า 2 เท่าของมวลโปรตอนทั้งหมดรวมกันดังนั้นอิเล็กตรอนโปรตอนและนิวตรอนจึงเป็นอนุภาคในอะตอม
ในปีพศ 2475 เจมส์แชดวิก นักวิทยาศาสตร์ชาวอังกฤษได้ทดลองยิงอนุภาคแอลฟาเพลงอะตอมของธาตุต่างๆและทดสอบผลการทดลองด้วยเครื่องมือที่มีความเสี่ยงสูงทำให้ทราบว่าในนิวเคลียสมีอนุภาคที่เป็นกลางทางไฟฟ้าและเรียกว่านิวตรอนซึ่งมีมวลใกล้เคียงกับมวลของโปรตอนการค้นพบนิวตรอนช่วยอธิบายและสนับสนุนข้อมูลเกี่ยวกับมวลของอะตอมซึ่งคำว่ามีค่ามากกว่ามวลรวมของโปรตอนเสื้อผ้าคาร์บอนมีมวลของโปรตอนรวมกัน 6 หน่วยประมวลของอะตอมมีค่า 12 หน่วยและมวลของธาตุส่วนใหญ่มีค่าเป็น 2 เท่าหรือมากกว่า 2 เท่าของมวลโปรตอนทั้งหมดรวมกันดังนั้นอิเล็กตรอนโปรตอนและนิวตรอนจึงเป็นอนุภาคในอะตอม
2.2.2 เลขอะตอมเลขมวลและไอโซโทป
อะตอมประกอบด้วยโปรตอนและนิวตรอนรวมกันเป็นนิวเคลียสของอะตอมและมีอิเล็กตรอนซึ่งมีจำนวนเท่ากับจำนวนโปรตอนเคลื่อนที่อยู่รอบๆอะตอมของธาตุแต่ละชนิดมีจำนวนโปรตอนเฉพาะตัวไม่ซ้ำกับธาตุอื่นตัวเลขที่แสดงจํานวนโปรตอน เรียกว่า เลขอะตอม และเนื่องจากมวลของอิเล็กตรอนมีค่าน้อยมากดังนั้นเมื่อของอะตอมส่วนใหญ่จึงเป็นมวลของนิวเคลียสซึ่งประกอบด้วยโปรตอนและนิวตรอน ผลรวมของจำนวนโปรตอนและนิวตรอน ว่า เลขมวล สัญลักษณ์ที่แสดงรายละเอียดเกี่ยวกับสัญลักษณ์ของธาตุเลขอะตอมและเลขมวลของอะตอมเรียกว่าสัญลักษณ์นิวเคลียส
อะตอมประกอบด้วยโปรตอนและนิวตรอนรวมกันเป็นนิวเคลียสของอะตอมและมีอิเล็กตรอนซึ่งมีจำนวนเท่ากับจำนวนโปรตอนเคลื่อนที่อยู่รอบๆอะตอมของธาตุแต่ละชนิดมีจำนวนโปรตอนเฉพาะตัวไม่ซ้ำกับธาตุอื่นตัวเลขที่แสดงจํานวนโปรตอน เรียกว่า เลขอะตอม และเนื่องจากมวลของอิเล็กตรอนมีค่าน้อยมากดังนั้นเมื่อของอะตอมส่วนใหญ่จึงเป็นมวลของนิวเคลียสซึ่งประกอบด้วยโปรตอนและนิวตรอน ผลรวมของจำนวนโปรตอนและนิวตรอน ว่า เลขมวล สัญลักษณ์ที่แสดงรายละเอียดเกี่ยวกับสัญลักษณ์ของธาตุเลขอะตอมและเลขมวลของอะตอมเรียกว่าสัญลักษณ์นิวเคลียส
นักเคมีชาวอังกฤษอะตอมของธาตุเดียวกันที่มีเลขมวลต่างกันว่าไอโซโทป นอกจากนี้ยังมี ไอโซโทน ซึ่งหมายถึง ธาตุต่างชนิดกันแต่มีนิวตรอนเท่ากัน ไอโซบาร์ หมายถึง ธาตุต่างชนิดกันเลขมวลเท่ากันแต่ละอะตอมต่างกัน และไอโซอิเล็กทรอนิกส์ หมายถึง ธาตุหรือไอออนที่มีจำนวนอิเล็กตรอนเท่ากัน
2.3 การจัดเรียงอิเล็กตรอนในอะตอม
2.3.1 จำนวนอิเล็กตรอนในแต่ละระดับพลังงาน
โปรตอนและนิวตรอนอยู่รวมกันในนิวเคลียสโดยอิเล็กตรอนเคลื่อนที่อยู่รอบรอบและอยู่ในระดับพลังงานต่างกันเล็กตอนเหล่านั้นอยู่กันอย่างไรและในแต่ละระดับพลังงาน
2.3 การจัดเรียงอิเล็กตรอนในอะตอม
2.3.1 จำนวนอิเล็กตรอนในแต่ละระดับพลังงาน
โปรตอนและนิวตรอนอยู่รวมกันในนิวเคลียสโดยอิเล็กตรอนเคลื่อนที่อยู่รอบรอบและอยู่ในระดับพลังงานต่างกันเล็กตอนเหล่านั้นอยู่กันอย่างไรและในแต่ละระดับพลังงาน
เมื่อพิจารณาข้อมูลแล้วจะพบว่าจำนวนอิเล็กตรอนในระดับพลังงานที่ 1 มีได้มากที่สุดคือ 2 อิเล็กตรอนระดับพลังงานที่ 2 มีได้มากที่สุดคือแบบอิเล็กตรอนสำหรับระดับพลังงานที่ 3 จากการสืบค้นข้อมูลเพิ่มเติมทำให้ทราบว่ามีมากที่สุด 18 อิเล็กตรอนด้วยคือจำนวนอิเล็กตรอนมากที่สุดที่มีได้ในแต่ระดับพลังงานจะมีค่าเท่ากับ 2n^2 เมื่อ n คือตัวเลขแสดงระดับพลังงานถ้าพิจารณาตามหลัก 2n^2 การจัดเรียงอิเล็กตรอนของธาตุ K และ Ca ควรเป็น 289 และจากการศึกษาพบว่าการจัดเรียงอิเล็กตรอนของธาตุ K และ Ca เป็น 2 8 8 1 และ 2 8 8 2 ตามลำดับซึ่งหมายความว่าอิเล็กตรอนในระดับพลังงานที่ 3 ของธาตุทั้งสองมีเพียง 8 อิเล็กตรอนและอิเล็กตรอนที่เพิ่มมา 1 และ 2 อิเล็กตรอนนั้นเข้าไปอยู่ในระดับพลังงานที่ 4 ทำให้ระดับพลังงานที่ 3 มีอิเล็กตรอนไม่ครบ 18 อิเล็กตรอน
2.3.2 ระดับพลังงานหลักและระดับพลังงานย่อย
2.3.2 ระดับพลังงานหลักและระดับพลังงานย่อย
จากการศึกษาของนักวิทยาศาสตร์โดยอาศัยสมบัติที่เป็นคลื่นของอิเล็กตรอน และใช้ความรู้เกี่ยวกับกลศาสตร์ควอนตัม เพื่อนำไปอธิบายโคร้างสร้างอะตอม ทำให้ทราบว่าอิเล็กตรอนอยู่ในระดับพลังงานหรือวาง (shell) ต่างๆ กัน และในระดับพลังงานเดียวกันยังมีการแบ่งเป็นระดับพลังงานย่อย (sub
shell) ต่างๆ ซึ่งกำหนดเป็นตัวอักษร s
p d และ f ตามลำดับด้วย
-ระดับพลังงานที่ 1 (n = 1) มี
1 ระดับพลังงานย่อยคือ s
-ระดับพลังงานที่ 2 (n = 2) มี 2 ระดับพลังงานย่อยคือ s p
-ระดับพลังงานที่ 3 (n = 3) มี 3 ระดับพลังงานย่อยคือ s p d
-ระดับพลังงานที่ 4 (n = 4) มี 4 ระดับพลังงานย่อยคือ s p d f
2.3.3 ออร์บิทัล
อิเล็กตรอนมีการเคลื่อนที่ตลอดเวลาความหนาแน่นของกลุ่มหมอกอิเล็กตรอน ซึ่งอยู่ในรูปของโอกาสที่จะพบอิเล็กตรอนซึ่งมีอาณาเขตและรูปร่างใน 3 มิติแตกต่างกันบริเวณรอบนิวเคลียสซึ่งมีโอกาสที่จะพบอิเล็กตรอนและมีพลังงานเฉพาะนี้เรียกว่าออร์ทัล
-ระดับพลังงานที่ 2 (n = 2) มี 2 ระดับพลังงานย่อยคือ s p
-ระดับพลังงานที่ 3 (n = 3) มี 3 ระดับพลังงานย่อยคือ s p d
-ระดับพลังงานที่ 4 (n = 4) มี 4 ระดับพลังงานย่อยคือ s p d f
2.3.3 ออร์บิทัล
อิเล็กตรอนมีการเคลื่อนที่ตลอดเวลาความหนาแน่นของกลุ่มหมอกอิเล็กตรอน ซึ่งอยู่ในรูปของโอกาสที่จะพบอิเล็กตรอนซึ่งมีอาณาเขตและรูปร่างใน 3 มิติแตกต่างกันบริเวณรอบนิวเคลียสซึ่งมีโอกาสที่จะพบอิเล็กตรอนและมีพลังงานเฉพาะนี้เรียกว่าออร์ทัล
ในแต่ละระดับพลังงานย่อยจะมีจำนวนออร์บิทัลแตกต่างกันดังนี้
-ระดับพลังงานย่อย s มี 1 ออร์บิลทัล
-ระดับพลังงานย่อย p มี 3 ออร์บิลทัล
-ระดับพลังงานย่อย d มี 5 ออร์บิลทัล
-ระดับพลังงานย่อย f มี 7 ออร์บิลทัล
-ระดับพลังงานย่อย s มี 1 ออร์บิลทัล
-ระดับพลังงานย่อย p มี 3 ออร์บิลทัล
-ระดับพลังงานย่อย d มี 5 ออร์บิลทัล
-ระดับพลังงานย่อย f มี 7 ออร์บิลทัล
การศึกษา พบว่าจำนวนออร์บิทัลในแต่ละพลังงานย่อยมีค่าแตกต่างกันซึ่งสรุปได้ดังนี้ระดับพลังงานย่อย s มี 1 ออร์บิทัล ระดับพลังงานย่อย p มี 3 ออร์บิทัล ระดับพลังงานย่อยดีมี 5 ออร์บิทัล รอบพลังงานย่อย f มี 7 ออร์บิทัล
2.3.4หลักการจัดเรียงอิเล็กตรอนในอะตอม
การจัดเรียงอิเล็กตรอนของอะตอมหนึ่งๆให้พิจารณาตาม หลักอาฟบาว (Aufbau principle)ซึ่งเกี่ยวข้องกับระดับพลังงานของแต่ละออร์บิทัล กล่าวคือการบรรจุอิเล็กตรอนต้องบรรจุในออร์บิทัลที่มีพลังงานต่ำสุดและว่างอยู่ก่อนเสมอ นั่นคือเริ่มจาก 1s 2s 2p 3s ... ตามลำดับเพราะจะทำให้พลังงานรวมทั้งหมดมีค่าต่ำที่สุดและอะตอมมีความเสถียรที่สุด1s1
จากแผนภาพสามารถเรียงลำดับพลังงานได้ดังนี้
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f
5d 6p 7s ...
สำหรับธาตุNa Mg Al Si P S Cl Ar K และ Ca ซึ่งมีอิเล็กตรอน 11 12 13 14 15 16 17 18 19 และ 20 ตามลำดับ สามารถเขียนสัญลักษณ์แสดงการจัดเรียงอิเล็กตรอนแบบเต็มและแบบย่อโดยเขียนแก๊สมีสกุลในวงเล็บแทนการจัดเรียงอิเล็กตรอนของแก๊สมีสกุลในชั้นถัดไปและแสดงการจัดเรียงอิเล็กตรอนเฉพาะชั้นนอกสุด
การบรรจุอิเล็กตรอนตามลำดับระดับพลังงานโดยการอาศัยแผนภาพตามหลักอาฟบาวดังที่กล่าวมาแล้ว มีบางธาตุที่การบรรจุอิเล็กตรอนในระดับพลังงานย่อยไม่เป็นไปตามหลักการนั้นเช่น ธาตุ Cr เลขอะตอม 24 แสดงการบรรจุอิเล็กตรอนในออร์บิทัลต่างๆได้ ดังนี้
1s2 2s2 2p6 3s2 3p6 3d5 4s1
2, 8, 13, 1
2.4 ตารางธาตุและสมบัติของธาตุหมู่หลัก
ธาตุจำนวนมากมีสมบัติบางประการคล้ายกัน และบางประการแตกต่างกันจึงยากที่จะจดจำสมบัติต่างๆของแต่ละธาตุได้ทั้งหมดนักวิทยาศาสตร์จึงหาเกณฑ์ในการจัดธาตุที่มีสมบัติคล้ายการให้อยู่ในกลุ่มเดียวกัน
2.4.1 วิวัฒนาการของตารางธาตุ
ในปีพศ. 2360 โยฮันน์เดอเบอไรเนอร์ เต้นนักเคมีคนแรกที่พยายามจัดตารางธาตุเป็นกลุ่มกลุ่มกลุ่มละ 3 ตามสมบัติที่คล้ายคลึงกันเรียกว่าชุดสาม โดยพบว่าท่าทางจะมีมวลอะตอมเป็นค่าเฉลี่ยของมวลอะตอมของอีก 2 ธาตุที่เหลือ
ในปีพ. ศ. 2427 จอห์นนิวแลนด์ นักวิทยาศาสตร์ชาวอังกฤษได้เสนอในการจัดธาตุเป็นหมวดหมู่ว่า ถ้าเรียงธาตุมวลอะตอมจากน้อยไปมากพบว่าถ้าที่ 8 จะมีสมบัติเหมือนท่าที่หนึ่งเสมอ โดยไม่รวมค่าไฮโดรเจนและแก๊สมีสกุล การจัดเรียงธาตุตามแนวคิดของนิวตันใช้ได้ถึงธาตุแคลเซียมเท่านั้นกดนี้ไม่สามารถอธิบายได้เพราะว่า เหตุใดมวลอะตอมจึงเกี่ยวข้องกับสมบัติที่คล้ายคลึงกันของธาตุทำให้ไม่เป็นที่ยอมรับในเวลา
ในปีพ.ศ. 2412 ยูลิอุส โลทาร์ ไมเออร์ นักวิทยาศาสตร์ชาวเยอรมันและ ดิมิทรี เมนเดเลเอฟ มีข้อสังเกตว่าถ้าท่านเองตามมวลอะตอมจากน้อยไปมากจะพบว่าธาตุมีสมบัติคล้ายกันเป็นช่วงช่วงการที่ธาตุต่างๆมีสมบัติคล้ายกันเป็นช่วงช่วงเช่นนี้ จึงต้องเป็นกรดเรียกว่ากฎพิริออดิก การจัดธาตุเป็นหมวดหมู่ของเมนเดเลเอฟ ไม่ได้หยุดการเรียงลำดับตามมวลอะตอมจากน้อยไปมากเพียงอย่างเดียวแต่ได้นำสมบัติที่คล้ายคลึงกันของธาตุที่ปรากฏซ้ำกันเป็นช่วงๆมาพิจารณาด้วยนอกจากนี้ยังได้เว้นช่องว่างไว้โดยคิดว่าน่าจะเป็นตำแหน่งของธาตุที่ยังไม่ได้มีการค้นพบโดยที่ตำแหน่งของธาตุในตารางธาตุมีความสัมพันธ์ กับสมบัติของธาตุเมนเดเลเอฟ จึงได้ทำนายสมบัติของธาตุ ที่ยังไม่ได้มีการค้นพบ 3 ธาตุและให้ชื่อว่า เอคา-โบรอน เอคา-อะลูมิเนียม และ เอคา-ซิลิกอน ในเวลาต่อมา ก็ได้ค้นพบธาตุสแกนเดียม แกลเลียม และเจอร์เมเนียมตามลำดับ
ในปีพ. ศ. 2456 เฮนรี โมสลีย์ นักวิทยาศาสตร์ชาวอังกฤษ เสนอให้จัด ธาตุเรียงตามเลขอะตอม เนื่องจากสมบัติต่างๆของธาตุมีความสัมพันธ์กับประจุบวกในนิวเคลียสหรือเลขอะตอมมากกว่ามวลอะตอม ตารางธาตุในปัจจุบันจึงได้ปรับปรุงมา
2.4.2 กลุ่มของธาตุในตารางธาตุ
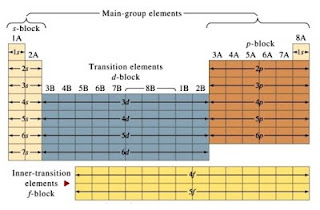
นักวิทยาศาสตร์จัดธาตุในตารางธาตุเป็นหมู่และคาบเพื่อให้ง่ายต่อการศึกษาสมบัติของธาตุต่างๆ ถ้าแบ่งกลุ่มธาตุตามสมบัติความเป็นโลหะจะแบ่งได้เป็น 3 กลุ่ม คือ ธาตุโลหะ เป็นธาตุที่นำไฟฟ้าและนำความร้อนได้ดี ธาตุกึ่งโลหะ เป็นธาตุนำไฟฟ้าได้ไม่ดีที่อุณหภูมิห้องแต่นำไฟฟ้าได้ดีขึ้นเมื่ออุณหภูมิสูงขึ้น และ ธาตุอโลหะ ซึ่งไม่นำไฟฟ้า ยกเว้นคาร์บอน (แกรไฟต์) และฟอสฟอรัสดำ ตำแหน่งของธาตุในตารางธาตุพบว่า ธาตุโลหะอยู่ทางด้านซ้ายมือของตารางธาตุ ธาตุกึ่งโลหะอยู่บริเวณที่เป็นขั้นบันได และธาตุอโลหะอยู่ขวามือของตารางธาตุ ยกเว้นไฮโดรเจนอยู่ทางด้านซ้ายมือของตารางธาตุ
ถ้าแบ่งกลุ่มธาตุในตารางธาตุโดยพิจารณาการจัดเรียงอิเล็กตรอนในออร์บิทัล s p d และ f ที่มีพลังงานสูงสุดและมีอิเล็กตรอนบรรจุอยู่ จะแบ่งธาตุออกเป็น 4 กลุ่มใหญ่คือ ธาตุกลุ่ม s ได้แก่ธาตุในหมู่ 1 และ 2 ธาตุกลุ่ม p ได้แก่ธาตุในหมู่ 13ถึง 18 ยกเว้น He ธาตุกลุ่ม d ได้แก่ ธาตุในหมู่ 3 ถึง 12 ส่วนธาตุในกลุ่ม f ได้แก่ กลุ่มธาตุที่อยู่ด้านล่างของตารางธาตุที่แยกมาจากหมู่ 3 คาบที่ 6 และ 7
ธาตุกลุ่ม s และกลุ่ม p เรียกรวมกันว่า ธาตุกลุ่ม A ซึ่งเป็นธาตุเรพรีเซนเททีฟ (representtative element) หรืออาจเรียกว่ากลุ่มธาตุหมู่หลัก (main group element) เมื่อพิจารณาการจัดเรียงอิเล็กตรอนของธาตุกลุ่ม A พบว่าธาตุในแนวตั้งที่อยู่ในกลุ่ม A จะมีเวเลนซ์อิเล็กตรอนเท่ากันและจำนวนเวเลนซ์อิเล็กตรอนจะตรงกับเลขหมู่ สำหรับธาตุตามแนวนอนที่อยู่ในคาบเดียวกัน พบว่ามีจำนวนระดับพลังงานเท่ากัน และจำนวนระดับพลังงานจะตรงกับเลขที่คาบ
2.4.3 ขนาดอะตอม
อิเล็กตรอนที่อยู่รอบนิวเคลียสจะเคลื่อนที่ตลอดเวลาด้วยความเร็วสูงและไม่สามารถบอกตำแหน่งที่แน่นอนรวมทั้งไม่สามารถกำหนดขอบเขตที่แน่นอนของอิเล็กตรอนได้นอกจากนี้อะตอมโดยทั่วไปไม่อยู่เป็นอะตอมเดียวแต่จะมีแรงยึดเหนี่ยวระหว่างอะตอมไว้ด้วยกันถึงเป็นเรื่องยากที่จะวัดขนาดอะตอมที่อยู่ในสภาวะอิสระหรือเป็นอะตอมเดี่ยวในทางปฏิบัติจึงบอกขนาดอะตอมด้วยรัศมีอะตอมซึ่งกำหนดให้มีค่าเท่ากับครึ่งหนึ่งของระยะทางระหว่างนิวเคลียสของอะตอมทั้ง 2 ที่มีแรงยึดเหนี่ยวระหว่างอะตอมไว้ด้วยกันหรือที่อยู่ชิดกัน เพื่อศึกษา รัศมีอะตอมของธาตุทำให้ทราบขนาดอะตอมของธาตุและสามารถเปรียบเทียบขนาดอะตอมของธาตุที่อยู่ในคาบเดียวกันหรือหมู่เดียวกันได้
2.4.3 ขนาดอะตอม
อิเล็กตรอนที่อยู่รอบนิวเคลียสจะเคลื่อนที่ตลอดเวลาด้วยความเร็วสูงและไม่สามารถบอกตำแหน่งที่แน่นอนรวมทั้งไม่สามารถกำหนดขอบเขตที่แน่นอนของอิเล็กตรอนได้นอกจากนี้อะตอมโดยทั่วไปไม่อยู่เป็นอะตอมเดียวแต่จะมีแรงยึดเหนี่ยวระหว่างอะตอมไว้ด้วยกันถึงเป็นเรื่องยากที่จะวัดขนาดอะตอมที่อยู่ในสภาวะอิสระหรือเป็นอะตอมเดี่ยวในทางปฏิบัติจึงบอกขนาดอะตอมด้วยรัศมีอะตอมซึ่งกำหนดให้มีค่าเท่ากับครึ่งหนึ่งของระยะทางระหว่างนิวเคลียสของอะตอมทั้ง 2 ที่มีแรงยึดเหนี่ยวระหว่างอะตอมไว้ด้วยกันหรือที่อยู่ชิดกัน เพื่อศึกษา รัศมีอะตอมของธาตุทำให้ทราบขนาดอะตอมของธาตุและสามารถเปรียบเทียบขนาดอะตอมของธาตุที่อยู่ในคาบเดียวกันหรือหมู่เดียวกันได้
ขนาดอะตอมมีแนวโน้มลดลงหมายเลขอะตอมเพิ่มขึ้นอธิบายได้ว่าเนื่องจากธาตุในคาบเดียวกันมีเวเลนซ์อิเล็กตรอนอยู่ในระดับพลังงานเดียวกันแต่มีจำนวนโปรตอนในนิวเคลียสต่างกันเท่าที่มีจำนวนโปรตอนมากจะดึงดูดเวเลนซ์อิเล็กตรอนด้วยอะไรที่มากกว่าธาตุที่มีจำนวนโปรตอนน้อยเวเลนซ์อิเล็กตรอนจึงเข้าใกล้นิวเคลียสได้มากกว่าทำให้อิเล็กตรอนมีขนาดเล็กลงส่วนธาตุในหมู่เดียวกันเมื่อใดอะตอมเพิ่มขึ้นจำนวนโปรตอนในนิวเคลียสและจำนวนระดับพลังงานที่มีต่ออีก 1 ตอนเพิ่มขึ้นด้วยอิเล็กตรอนที่อยู่ในชั้นในจึงเป็นคล้ายฉากกั้นแรงดึงดูดระหว่างโปรตอนในนิวเคลียสกับเวเลนซ์อิเล็กตรอนทำให้แรงดึงดูดต่อ เวเลนซ์อิเล็กตรอน มีน้อยเป็นผลให้ธาตุในหมู่เดียวกันมีขนาดอะตอมใหญ่ขึ้นตามเลขอะตอม
2.4.4 ขนาดไอออน
อะตอมซึ่งมีจำนวนโปรตอนเท่ากับอิเล็กตรอนเมื่อรับอิเล็กตรอนเพิ่มเข้ามาหรือเสียอิเล็กตรอนออกไปอะตอมจะกลายเป็นไอออนการบอกขนาดของไอออนทำได้เช่นเดียวกับการบอกขนาดของอะตอม กล่าวคือ จะบอกเป็นค่ารัศมีไอออนซึ่งพิจารณาจากระยะทางระหว่างนิวเคลียสของไอออนคู่หนึ่งหนึ่งที่ยึดเหนี่ยวซึ่งกันและกันในโครงผลึก
2.4.4 ขนาดไอออน
อะตอมซึ่งมีจำนวนโปรตอนเท่ากับอิเล็กตรอนเมื่อรับอิเล็กตรอนเพิ่มเข้ามาหรือเสียอิเล็กตรอนออกไปอะตอมจะกลายเป็นไอออนการบอกขนาดของไอออนทำได้เช่นเดียวกับการบอกขนาดของอะตอม กล่าวคือ จะบอกเป็นค่ารัศมีไอออนซึ่งพิจารณาจากระยะทางระหว่างนิวเคลียสของไอออนคู่หนึ่งหนึ่งที่ยึดเหนี่ยวซึ่งกันและกันในโครงผลึก
เมื่อโลหะทำปฏิกิริยากับอโลหะอะตอมของโลหะจะเสียเวลาแต่เล็กจนกลายเป็นไอออนบวกจำนวนอิเล็กตรอนในอะตอมจึงลดลงทำให้แรงผลักระหว่างอิเล็กตรอนลดลงด้วยหรือกล่าวอีกนัยหนึ่งก็คือแรงดึงดูดระหว่าง ประจุในนิวเคลียสกับอิเล็กตรอนจากเพิ่มมากขึ้น อะตอมของอโลหะนั้นส่วนใหญ่จะรับอิเล็กตรอนเพิ่มเข้ามาและเกิดเป็นไอออนลบเนื่องจากมีการเพิ่มขึ้นของจำนวนอิเล็กตรอนขอบเขตของกลุ่มหมอกอิเล็กตรอนจะขยายออกไปจากเดิมไอออนลบจึงมีขนาดใหญ่กว่าอะตอมเดิม
เมื่อพิจารณาแนวโน้มของรัศมีอะตอมและรัศมีไอออนตามหมู่ ส่วนใหญ่มีแนวโน้มมีขนาดเพิ่มขึ้นจากบนลงล่างเช่นเดียวกับขนาดอะตอม รัศมีไอออนบวกจะมีค่าน้อยกว่ารัศมีอะตอม แต่รัศมีไอออนลบจะมีค่ามากกว่ารัศมีอะตอม
2.4.5 พลังงานไอออไนเซชัน
พลังงานปริมาณน้อยที่สุดที่ทำให้อิเล็กตรอนหลุดจากอะตอมในสถานะแก๊สเรียกว่าพลังงานไอออไนเซชัน โดยค่า IE แสดงถึงความยากง่ายในการทำให้ อะตอมในสถานะแก๊สกลายเป็นไอออนบวก โดยอีน้อยแสดงว่าทำให้เป็นไอออนบวกได้ง่ายแต่ถ้า IE มากแสดงว่าทำให้เป็นไอออนบวกได้ยากก็ทำให้ไฮโดรเจนอะตอมในสถานะแก๊สกลายเป็นไรโดยเช่นไอออนและสถานะแก๊สเขียนได้ดังนี้
H(g) ----> H^+(g) + e^-
การทำให้อิเล็กตรอนหลุดออกจากอะตอมของไฮโดรเจนจะต้องใช้พลังงานอย่างน้อยที่สุด 1318 กิโลจูลต่อโมล นั่นคือ พลังงานไอออไนเซชันของไฮโดรเจนอะตอมเท่ากับ 1318 กิโลจูลต่อโมล ธาตุไฮโดรเจน มี 1 อิเล็กตรอนจึงมีค่าพลังงานไอออไนเซชันเพียงค่าเดียวถ้าธาตุที่มีหลายอิเล็กตรอน ก็จะมีพลังงานไอออไนเซชันหลายค่าพลังงานที่น้อยที่สุดที่ทำให้อิเล็กตรอนตัวแรกหลุดออกมาจากอะตอม ที่อยู่ในสถานะแก๊สเรียกว่าพลังงานไอออไนเซชันลำดับที่ 1 เขียนย่อเป็น IE 1 พลังงานที่ทำให้อิเล็กตรอนในลำดับต่อๆมาหลุดออกมาจากอะตอมเรียกว่าพลังงานไอออไนเซชันลำดับที่ 2
3 ... และเขียนย่อเป็น IE 2 IE 3 ตามลำดับ
2.4.6 สัมพรรคภาพอิเล็กตรอน
พลังงานที่ถูกคายออกมาเมื่ออะตอมในสถานะแก๊สได้รับอิเล็กตรอน 1 อิเล็กตรอนเลขว่าสัมพรรคภาพอิเล็กตรอนเขียนสมการการเปลี่ยนแปลงได้ดังนี้
A(g) + e^- ---> A^-(g)
หาค่าสัมพรรคภาพอิเล็กตรอน มีค่าเป็นบวกหมายความว่าอะตอมคายพลังงานเมื่อได้รับอิเล็กตรอนแสดงว่าอะตอมของธาตุนั้นมีแนวโน้มที่จะได้รับอิเล็กตรอนได้ดี ถ้าค่าสัมพรรคภาพอิเล็กตรอนเป็นลบแปลว่าต้องใช้พลังงานเพิ่มเข้าไปเพื่อให้และรับอิเล็กตรอนได้เพิ่มขึ้น 1 อิเล็กตรอน เมื่อพิจารณาตามข้อพบว่าค่าสัมพรรคภาพอิเล็กตรอนของธาตุอโลหะยกเว้น หมู่ VIIIA มีค่ามากกว่าธาตุโลหะแสดงว่าธาตุอโลหะมีแนวโน้มที่จะได้รับอิเล็กตรอนได้ดีกว่าถ้าโลหะเมื่อพิจารณาโดยภาพรวมทั้งหมดจะพบว่าธาตุหมู่ VIIA มีค่าสัมพรรคภาพอิเล็กตรอนสูงที่สุดแสดงว่ามีแนวโน้มในการรับอิเล็กตรอนได้ดีกว่าท่านผู้อื่นที่เป็นเช่นนี้อาจอธิบายได้ว่าการรับ 1 อิเล็กตรอนของธาตุในหมู่นี้จะทำให้มีอะตอมที่มีการจัดเรียงอิเล็กตรอนของธาตุหมู่ VIIA หรือแก๊สมีสกุลซึ่งมีความเสถียรมาก
2.4.7 อิเล็กโทรเนกาติวิตี
อิเล็กโทรเนกาติวิตี คือ ความสามารถของอะตอมในการดึงดูดอีเล็คตรอนคู่ที่ใช้ร่วมกันในโมเลกุลของสารแนวโน้มค่าอิเล็กโทรเนกาติวิตีของธาตุ เมื่อพิจารณาค่าอิเล็กโทรเนกาติวิตีของธาตุในคาบเดียวกันพบว่ามีแนวโน้มเพิ่มขึ้นตามเลขอะตอมเนื่องจากในคาบเดียวกันอะตอมของธาตุหมู่ IA มีขนาดใหญ่ที่สุดและหมู่ VIIA มีขนาดเล็กที่สุด ความสามารถในการดึงดูดอีเล็คตรอนตามข้ามจึงเพิ่มขึ้นจากหมู่ IA ไปหมู่ VIIA ดังนั้นในคาบเดียวกันธาตุหมู่ IA จึงมีค่าอิเล็กโทรเนกาติวิตีต่ำที่สุดควรธาตุหมู่ VIIA มีค่าอิเล็กโทรเนกาติวิตีสูงที่สุดธาตุในหมู่เดียวกันมีแนวโน้มของค่าอิเล็กโทรเนกาติวิตี ลดลงเมื่อเลขอะตอมเพิ่มขึ้นเนื่องจากขนาดของอะตอมที่เพิ่มขึ้นเป็นผลให้นิวเคลียสดึงดูดอิเล็กตรอนลดลง
2.4.6 สัมพรรคภาพอิเล็กตรอน
พลังงานที่ถูกคายออกมาเมื่ออะตอมในสถานะแก๊สได้รับอิเล็กตรอน 1 อิเล็กตรอนเลขว่าสัมพรรคภาพอิเล็กตรอนเขียนสมการการเปลี่ยนแปลงได้ดังนี้
A(g) + e^- ---> A^-(g)
หาค่าสัมพรรคภาพอิเล็กตรอน มีค่าเป็นบวกหมายความว่าอะตอมคายพลังงานเมื่อได้รับอิเล็กตรอนแสดงว่าอะตอมของธาตุนั้นมีแนวโน้มที่จะได้รับอิเล็กตรอนได้ดี ถ้าค่าสัมพรรคภาพอิเล็กตรอนเป็นลบแปลว่าต้องใช้พลังงานเพิ่มเข้าไปเพื่อให้และรับอิเล็กตรอนได้เพิ่มขึ้น 1 อิเล็กตรอน เมื่อพิจารณาตามข้อพบว่าค่าสัมพรรคภาพอิเล็กตรอนของธาตุอโลหะยกเว้น หมู่ VIIIA มีค่ามากกว่าธาตุโลหะแสดงว่าธาตุอโลหะมีแนวโน้มที่จะได้รับอิเล็กตรอนได้ดีกว่าถ้าโลหะเมื่อพิจารณาโดยภาพรวมทั้งหมดจะพบว่าธาตุหมู่ VIIA มีค่าสัมพรรคภาพอิเล็กตรอนสูงที่สุดแสดงว่ามีแนวโน้มในการรับอิเล็กตรอนได้ดีกว่าท่านผู้อื่นที่เป็นเช่นนี้อาจอธิบายได้ว่าการรับ 1 อิเล็กตรอนของธาตุในหมู่นี้จะทำให้มีอะตอมที่มีการจัดเรียงอิเล็กตรอนของธาตุหมู่ VIIA หรือแก๊สมีสกุลซึ่งมีความเสถียรมาก
2.4.7 อิเล็กโทรเนกาติวิตี
อิเล็กโทรเนกาติวิตี คือ ความสามารถของอะตอมในการดึงดูดอีเล็คตรอนคู่ที่ใช้ร่วมกันในโมเลกุลของสารแนวโน้มค่าอิเล็กโทรเนกาติวิตีของธาตุ เมื่อพิจารณาค่าอิเล็กโทรเนกาติวิตีของธาตุในคาบเดียวกันพบว่ามีแนวโน้มเพิ่มขึ้นตามเลขอะตอมเนื่องจากในคาบเดียวกันอะตอมของธาตุหมู่ IA มีขนาดใหญ่ที่สุดและหมู่ VIIA มีขนาดเล็กที่สุด ความสามารถในการดึงดูดอีเล็คตรอนตามข้ามจึงเพิ่มขึ้นจากหมู่ IA ไปหมู่ VIIA ดังนั้นในคาบเดียวกันธาตุหมู่ IA จึงมีค่าอิเล็กโทรเนกาติวิตีต่ำที่สุดควรธาตุหมู่ VIIA มีค่าอิเล็กโทรเนกาติวิตีสูงที่สุดธาตุในหมู่เดียวกันมีแนวโน้มของค่าอิเล็กโทรเนกาติวิตี ลดลงเมื่อเลขอะตอมเพิ่มขึ้นเนื่องจากขนาดของอะตอมที่เพิ่มขึ้นเป็นผลให้นิวเคลียสดึงดูดอิเล็กตรอนลดลง
2.5 ธาตุแทรนซิชัน
สมบัติของธาตุหมู่ A มาแล้วต่อไปจะได้ศึกษาธาตุอีกกลุ่มหนึ่งซึ่งอยู่ระหว่างธาตุหมู่ IA และหมู่ IIIA ที่เรียกว่าถ้าแทรนซิชันประกอบด้วยธาตุหมู่ IB ถึงหมู่ VIIIB รวมทั้งกลุ่มธาตุแลนทานอยด์และแอกทินอยด์ ธาตุแทรนซิชันเหล่านี้มีอยู่ในธรรมชาติและได้จากการสังเคราะห์บ้างถ้าเป็นธาตุกัมมันตรังสี
2.5.1 สมบัติของธาตุแทรนซิชัน
ธาตุแทรนซิชันในคาบที่ 4 มีสมบัติหลายประการคล้ายกับโลหะหมู่หลักในคาบเดียวกันเช่นมีพลังงานไอออไนเซชันลำดับที่ 1 และค่าอิเล็กโทรเนกาติวิตีต่ำอย่างไรก็ตามธาตุแทรนซิชันซึ่งมีจุดหลอมเหลวจุดเดือดและความหนาแน่นสูงกว่าโลหะหมูน่ะ เมื่อพิจารณาขนาดอะตอมพบว่าถ้าธาตุแทรนซิชันมีขนาดใกล้เคียงกันและมีขนาดเล็กกว่าโลหะโพแทสเซียมและแคลเซียมเพื่ออธิบายเกี่ยวกับขนาดอะตอมของธาตุแทรนซิชันให้พิจารณาการจัดเรียงอิเล็กตรอนของธาตุโพแทสเซียมแคลเซียมและธาตุแทรนซิชันในคาบที่ 4 พบว่าธาตุแทรนซิชันในคาบที่ 4 ส่วนใหญ่มีจำนวนเวเลนซ์อิเล็กตรอนเป็น 2 และมีจำนวนอิเล็กตรอนในระดับพลังงานย่อยที่อยู่ถัดจากระดับพลังงานนอกสุดเข้าไปไม่เท่ากันเนื่องจากอิเล็กตรอนตัวสุดท้ายบรรจุอยู่ในระดับพลังงานย่อย 3d
สมบัติของธาตุหมู่ A มาแล้วต่อไปจะได้ศึกษาธาตุอีกกลุ่มหนึ่งซึ่งอยู่ระหว่างธาตุหมู่ IA และหมู่ IIIA ที่เรียกว่าถ้าแทรนซิชันประกอบด้วยธาตุหมู่ IB ถึงหมู่ VIIIB รวมทั้งกลุ่มธาตุแลนทานอยด์และแอกทินอยด์ ธาตุแทรนซิชันเหล่านี้มีอยู่ในธรรมชาติและได้จากการสังเคราะห์บ้างถ้าเป็นธาตุกัมมันตรังสี
2.5.1 สมบัติของธาตุแทรนซิชัน
ธาตุแทรนซิชันในคาบที่ 4 มีสมบัติหลายประการคล้ายกับโลหะหมู่หลักในคาบเดียวกันเช่นมีพลังงานไอออไนเซชันลำดับที่ 1 และค่าอิเล็กโทรเนกาติวิตีต่ำอย่างไรก็ตามธาตุแทรนซิชันซึ่งมีจุดหลอมเหลวจุดเดือดและความหนาแน่นสูงกว่าโลหะหมูน่ะ เมื่อพิจารณาขนาดอะตอมพบว่าถ้าธาตุแทรนซิชันมีขนาดใกล้เคียงกันและมีขนาดเล็กกว่าโลหะโพแทสเซียมและแคลเซียมเพื่ออธิบายเกี่ยวกับขนาดอะตอมของธาตุแทรนซิชันให้พิจารณาการจัดเรียงอิเล็กตรอนของธาตุโพแทสเซียมแคลเซียมและธาตุแทรนซิชันในคาบที่ 4 พบว่าธาตุแทรนซิชันในคาบที่ 4 ส่วนใหญ่มีจำนวนเวเลนซ์อิเล็กตรอนเป็น 2 และมีจำนวนอิเล็กตรอนในระดับพลังงานย่อยที่อยู่ถัดจากระดับพลังงานนอกสุดเข้าไปไม่เท่ากันเนื่องจากอิเล็กตรอนตัวสุดท้ายบรรจุอยู่ในระดับพลังงานย่อย 3d
2.6 ธาตุกัมมันตรังสี
ในปีพศ. 2439 อองตวนอองรีแบ็กเกอแรล นักวิทยาศาสตร์ชาวฝรั่งเศสพบว่าเมื่อเก็บแผ่นฟิล์มถ่ายรูปที่หุ้มด้วยกระดาษสีดำไว้กับสารประกอบของยูเรเนียม แผ่นฟิล์มจะมีลักษณะเหมือนถูกแสงและเมื่อทำการทดลองกับสารประกอบของยูเรเนียมชนิดอื่นๆก็ได้ผลเช่นเดียวกันจึงสรุปว่าน่าจะมีรังสีแพรออกมาจากธาตุยูเรเนียมต่อมาปีแอร์ กูรี และมารีกูรี ได้ค้นพบว่า ธาตุพอโลเนียมเรเดียมและทอเรียม ก็สามารถ รังสีได้เช่นเดียวกันปรากฏการณ์ที่ธาตุแพ้รังสีเองได้อย่างต่อเนื่องเรียกว่ากัมมันตภาพรังสี ซึ่งเป็นการเปลี่ยนแปลงภายในนิวเคลียส ของไอโซโทปที่ไม่เสถียรและไอโซโทปของธาตุที่สามารถแผ่รังสีเองได้อย่างต่อเนื่องเรียกว่าไอโซโทปกัมมันตรังสีหรือสารกัมมันตรังสี
ในปีพศ. 2439 อองตวนอองรีแบ็กเกอแรล นักวิทยาศาสตร์ชาวฝรั่งเศสพบว่าเมื่อเก็บแผ่นฟิล์มถ่ายรูปที่หุ้มด้วยกระดาษสีดำไว้กับสารประกอบของยูเรเนียม แผ่นฟิล์มจะมีลักษณะเหมือนถูกแสงและเมื่อทำการทดลองกับสารประกอบของยูเรเนียมชนิดอื่นๆก็ได้ผลเช่นเดียวกันจึงสรุปว่าน่าจะมีรังสีแพรออกมาจากธาตุยูเรเนียมต่อมาปีแอร์ กูรี และมารีกูรี ได้ค้นพบว่า ธาตุพอโลเนียมเรเดียมและทอเรียม ก็สามารถ รังสีได้เช่นเดียวกันปรากฏการณ์ที่ธาตุแพ้รังสีเองได้อย่างต่อเนื่องเรียกว่ากัมมันตภาพรังสี ซึ่งเป็นการเปลี่ยนแปลงภายในนิวเคลียส ของไอโซโทปที่ไม่เสถียรและไอโซโทปของธาตุที่สามารถแผ่รังสีเองได้อย่างต่อเนื่องเรียกว่าไอโซโทปกัมมันตรังสีหรือสารกัมมันตรังสี
2.6.1 การเกิดกัมมันตภาพรังสี
กัมมันตภาพรังสีเป็นปรากฏการณ์ที่เกิดกับไอโซโทปกัมมันตรังสีเพราะนิวเคลียสมีพลังงานสูงมากและไม่เสถียรจึงปล่อยพลังงานออกมาในรูปของอนุภาคหรือรังสี รังสีที่แผ่ออกมาจากไอโซโทปกัมมันตรังสีอาจเป็นรังสีแอลฟาบีตาหรือแกมมาสมบัติของรังสีบางชนิด
2.6.2 การสลายตัวของไอโซโทปกัมมันตรังสี
กัมมันตภาพรังสีเป็นปรากฏการณ์ที่เกิดกับไอโซโทปกัมมันตรังสีเพราะนิวเคลียสมีพลังงานสูงมากและไม่เสถียรจึงปล่อยพลังงานออกมาในรูปของอนุภาคหรือรังสี รังสีที่แผ่ออกมาจากไอโซโทปกัมมันตรังสีอาจเป็นรังสีแอลฟาบีตาหรือแกมมาสมบัติของรังสีบางชนิด
2.6.2 การสลายตัวของไอโซโทปกัมมันตรังสี
การเปลี่ยนแปลงภายในนิวเคลียสโดยการแผ่รังสี (rediation) ออกมาแล้วเกิดเป็นนิวเคลียสของธาตุใหม่ที่เสถียรกว่า
การแผ่รังสีแอลฟา ส่วนใหญ่เกิดกับนิวเคลียสที่มีเลขอะตอมสูงกว่า 83 และมีจำนวนนิวตรอนต่อโปรตอนในสัดส่วนที่ไม่เหมาะสม เมื่อปล่อยรังสีแอลฟาออกมาจะกลายเป็นนิวเคลียสของธาตุใหม่ที่เสถียรซึ่งมีเลขอะตอมลดลง 2 และเลขมวลลดลง 4
90Th 232----->88Ra 228 + 2a 4
การแผ่รังสีบีตา เกิดกับนิวเคลียสที่มีจำนวนนิวตรอนมากกว่าโปรตอนมาก นิวตรอนในนิวเคลียสจะเปลี่ยนไปเป็นโปรตอนและอิเล็กตรอน ซึ่งอิเล็กตรอนจะถูกปลดปล่อยออกจากนิวเคลียสในรูปของรังสีบีตาและนิวเคลียสใหม่จะมีเลขอะตอมเพิ่มขึ้น 1 โดยที่เลขมวลยังคงเดิม
79Au 198----->80Hg 198 + -1b 0
7N 13----->6C 13 + +1b 0
รังสีแกมมา
เกิดกับไอโซโทปกัมมันตรังสีที่มีพลังงานสูงมาก หรือไอโซโทปที่สลายตัวให้รังสีแอลฟาหรือบีตา แต่นิวเคลียสที่เกิดใหม่ยังไม่เสถียรเพราะมีพลังงานสูงจึงเกิดการเปลี่ยนแปลงในนิวเคลียสเพื่อให้มีพลังงานต่ำลง โดยปล่อยพลังงานส่วนเกินออกมาเป็นรังสีแกมมา
27Co 60----->-1b 0 + 28Ni
60----->28Ni60 + g
2.6.3 อันตรายจากไอโซโทปกัมมันตรังสี
กัมมันตรังสีเข้าสู่ร่างกายนอกจากนี้ยังได้รับรังสีคอสมิกซึ่งเป็นรังสีที่ส่วนใหญ่มาจากอวกาศและสิ่งต่างๆเหล่านี้ บางคนยังได้รับรังสีที่มนุษย์สร้างขึ้นมาเช่นรังสีจากโรงไฟฟ้านิวเคลียร์ แม้มนุษย์จะได้รับรังสีจากกิจวัตรประจำวันแต่การได้รับรังสีจากธรรมชาติหรือจากที่มนุษย์สร้างขึ้นในปริมาณเพียงเล็กน้อยโดยน้อยกว่า 100 มิลลิซีเวิร์ต เซลล์เนื้อเยื่อ สามารถฟื้นตัวได้แต่การได้รับรังสีมากกว่า 100 มิลลิซีเวิร์ต ทำให้เกิดความเสี่ยงต่อสุขภาพ หน่วยงานที่ทำงานเกี่ยวกับรังสีจะต้องแสดงสัญลักษณ์รังสีลงบนฉลาก ของพันชนะหรือเครื่องมือ รวมทั้งบริเวณใกล้เคียงเพื่อให้ผู้พบเห็นได้ระมัดระวัง สัญลักษณ์รังสีใช้เป็นมาตรฐานจะได้รูปใบพัด 3 แฉกมีสีม่วงอ่อนม่วงเข้มหรือสีดำบนพื้นสีเหลือง
กัมมันตรังสีเข้าสู่ร่างกายนอกจากนี้ยังได้รับรังสีคอสมิกซึ่งเป็นรังสีที่ส่วนใหญ่มาจากอวกาศและสิ่งต่างๆเหล่านี้ บางคนยังได้รับรังสีที่มนุษย์สร้างขึ้นมาเช่นรังสีจากโรงไฟฟ้านิวเคลียร์ แม้มนุษย์จะได้รับรังสีจากกิจวัตรประจำวันแต่การได้รับรังสีจากธรรมชาติหรือจากที่มนุษย์สร้างขึ้นในปริมาณเพียงเล็กน้อยโดยน้อยกว่า 100 มิลลิซีเวิร์ต เซลล์เนื้อเยื่อ สามารถฟื้นตัวได้แต่การได้รับรังสีมากกว่า 100 มิลลิซีเวิร์ต ทำให้เกิดความเสี่ยงต่อสุขภาพ หน่วยงานที่ทำงานเกี่ยวกับรังสีจะต้องแสดงสัญลักษณ์รังสีลงบนฉลาก ของพันชนะหรือเครื่องมือ รวมทั้งบริเวณใกล้เคียงเพื่อให้ผู้พบเห็นได้ระมัดระวัง สัญลักษณ์รังสีใช้เป็นมาตรฐานจะได้รูปใบพัด 3 แฉกมีสีม่วงอ่อนม่วงเข้มหรือสีดำบนพื้นสีเหลือง
2.6.4 ครึ่งชีวิตของไอโซโทปกัมมันตรังสีไอโซโทป
ธาตุกัมมันตรังสีจะสลายตัวให้รังสีชนิดใดชนิดหนึ่งออมาได้เองตลอดเวลา ธาตุกัมมันตรังสีแต่ละชนิดจะสลายตัวได้เร็วหรือช้าแตกต่างกัน ปริมาณการสลายตัวของธาตุกัมมันตรังสีจะบอกเป็น ครึ่งชีวิต ใช้สัญลักษณ์ครึ่งชีวิต หมายถึง ระยะเวลาที่นิวเคลียสของธาตุกัมมันตรังสี สลายตัวจนเหลือครึ่งหนึ่งของปริมาณเดิม ไอโซโทปกัมมันตรังสีของธาตุชนิดหนึ่งๆ จะมีครึ่งชีวิตคงเดิมไม่ว่าจะอยู่ในรูปของธาตุหรือเกิดเป็นสารประกอบ
2.6.5 ปฏิกิริยานิวเคลียร์
ปฏิกิริยานิวเคลียร์เป็นการเปลี่ยนแปลงในนิวเคลียสของไอโซโทปกัมมันตรังสีเกิดจากการแตกตัวของนิวเคลียสของอะตอมที่มีขนาดใหญ่หรือเกิดจากการรวมตัวของนิวเคลียสของอะตอมที่มีขนาดเล็กแล้วได้ไอโซโทปใหม่หรือนิวเคลียสของธาตุใหม่
ในปีพศ. 2482 นักวิทยาศาสตร์ได้ค้นพบว่าเมื่อยิงอนุภาคนิวตรอนไปยังนิวเคลียส U-235 นิวเคลียสจะแตกออกเป็นนิวเคลียสของธาตุที่เบากว่า กระบวนการที่นิวเคลียสของไอโซโทปของธาตุบางชนิดแตกออกเป็นไอโซโทปของธาตุที่เบากว่าดังซึ่งเรียกว่า ฟิชชัน ไอโซโทปของธาตุอื่นที่สามารถเกิดฟิชชันได้ เช่น U-238 การเกิดฟิชชัน นิวตรอนที่เกิดขึ้นใหม่นี้ชนกับนิวเคลียสอื่นจะเกิดเป็นฟิชชันต่อเนื่องไปเรื่อยๆเรียกปฏิกิริยานี้ว่า ปฏิกิริยาลูกโซ่ ฟิชชันที่เกิดภายในภาวะที่เหมาะสม จะได้จำนวนนิวตรอนเพิ่มขึ้นอย่างรวดเร็วทำให้ฟิชชัน ดำเนินไปอย่างรวดเร็วและปล่อยพลังงานออกมาเป็นจำนวนมหาศาล ในกรณีที่นิวเคลียสของธาตุเบา 2 ชนิดหลอมรวมกันเกิดเป็นนิวเคลียสใหม่ที่มีมวลสูงกว่า เดิมและให้พลังงานปริมาณมาก ปฏิกิริยานี้เรียกว่า ฟิวชัน ปฏิกิริยาทั้งสองนี้เป็นปฏิกิริยากับที่เกิดบนดวงอาทิตย์การเกิดฟิวชันจะต้องใช้พลังงานเริ่มต้นสูงมากและเอาชนะแรงผลักระหว่างนิวเคลียสที่จะเข้าร่วมกันซึ่งประมาณว่าจะต้องมีอุณหภูมิสูงถึงหลายล้านองศาเซลเซียส พลังงานมหาศาลนี้อ่านได้จากฟิชชันซึ่งเปรียบเสมือนฉนวนที่ทำให้เกิดฟิวชัน
ธาตุกัมมันตรังสีจะสลายตัวให้รังสีชนิดใดชนิดหนึ่งออมาได้เองตลอดเวลา ธาตุกัมมันตรังสีแต่ละชนิดจะสลายตัวได้เร็วหรือช้าแตกต่างกัน ปริมาณการสลายตัวของธาตุกัมมันตรังสีจะบอกเป็น ครึ่งชีวิต ใช้สัญลักษณ์ครึ่งชีวิต หมายถึง ระยะเวลาที่นิวเคลียสของธาตุกัมมันตรังสี สลายตัวจนเหลือครึ่งหนึ่งของปริมาณเดิม ไอโซโทปกัมมันตรังสีของธาตุชนิดหนึ่งๆ จะมีครึ่งชีวิตคงเดิมไม่ว่าจะอยู่ในรูปของธาตุหรือเกิดเป็นสารประกอบ
2.6.5 ปฏิกิริยานิวเคลียร์
ปฏิกิริยานิวเคลียร์เป็นการเปลี่ยนแปลงในนิวเคลียสของไอโซโทปกัมมันตรังสีเกิดจากการแตกตัวของนิวเคลียสของอะตอมที่มีขนาดใหญ่หรือเกิดจากการรวมตัวของนิวเคลียสของอะตอมที่มีขนาดเล็กแล้วได้ไอโซโทปใหม่หรือนิวเคลียสของธาตุใหม่
ในปีพศ. 2482 นักวิทยาศาสตร์ได้ค้นพบว่าเมื่อยิงอนุภาคนิวตรอนไปยังนิวเคลียส U-235 นิวเคลียสจะแตกออกเป็นนิวเคลียสของธาตุที่เบากว่า กระบวนการที่นิวเคลียสของไอโซโทปของธาตุบางชนิดแตกออกเป็นไอโซโทปของธาตุที่เบากว่าดังซึ่งเรียกว่า ฟิชชัน ไอโซโทปของธาตุอื่นที่สามารถเกิดฟิชชันได้ เช่น U-238 การเกิดฟิชชัน นิวตรอนที่เกิดขึ้นใหม่นี้ชนกับนิวเคลียสอื่นจะเกิดเป็นฟิชชันต่อเนื่องไปเรื่อยๆเรียกปฏิกิริยานี้ว่า ปฏิกิริยาลูกโซ่ ฟิชชันที่เกิดภายในภาวะที่เหมาะสม จะได้จำนวนนิวตรอนเพิ่มขึ้นอย่างรวดเร็วทำให้ฟิชชัน ดำเนินไปอย่างรวดเร็วและปล่อยพลังงานออกมาเป็นจำนวนมหาศาล ในกรณีที่นิวเคลียสของธาตุเบา 2 ชนิดหลอมรวมกันเกิดเป็นนิวเคลียสใหม่ที่มีมวลสูงกว่า เดิมและให้พลังงานปริมาณมาก ปฏิกิริยานี้เรียกว่า ฟิวชัน ปฏิกิริยาทั้งสองนี้เป็นปฏิกิริยากับที่เกิดบนดวงอาทิตย์การเกิดฟิวชันจะต้องใช้พลังงานเริ่มต้นสูงมากและเอาชนะแรงผลักระหว่างนิวเคลียสที่จะเข้าร่วมกันซึ่งประมาณว่าจะต้องมีอุณหภูมิสูงถึงหลายล้านองศาเซลเซียส พลังงานมหาศาลนี้อ่านได้จากฟิชชันซึ่งเปรียบเสมือนฉนวนที่ทำให้เกิดฟิวชัน
2.6.6 เทคโนโลยีที่เกี่ยวข้องกับการใช้สารกัมมันตรังสี
ด้านธรณีวิทยา ใช้ C-14 ซึ่งมีครึ่งชีวิต 5730 ปีหาอายุของวัตถุโบราณที่มีคาร์บอนเป็นองค์ประกอบ
ด้านธรณีวิทยา ใช้ C-14 ซึ่งมีครึ่งชีวิต 5730 ปีหาอายุของวัตถุโบราณที่มีคาร์บอนเป็นองค์ประกอบ
ด้านการแพทย์ ใช้เพื่อศึกษาความผิดปกติของอวัยวะต่างๆในร่างกาย
ด้านเกษตรกรรม ใช้ไอโซโทปกัมมันตรังสีในการติดตามระยะเวลาของการหมุนเวียนแร่ธาตุในพืช
ด้านอุตสาหกรรม ใช้ไอโซโทปกัมมันตรังสีกับงานหลายอย่างเช่นใช้ตรวจหารอยตำหนิในโลหะหรือรอยรั่วของท่อขนส่งของเหลวผสมไอโซโทปกัมมันตรังสีกับของเหลวที่จะขนส่งไปตามท่อและติดตามการแผ่รังสี เคาน์เตอร์ บริเวณใดที่มี
2.7 การนำภาพไปใช้ประโยชน์และผลกระทบต่อสิ่งมีชีวิตมนุษย์
2.7.1 ประโยชน์ของธาตุ
ธาตุโลหะมีสมบัติการนำความร้อนและนำไฟฟ้าได้ดีจึงนิยมนำมาทำเป็นอุปกรณ์ไฟฟ้า เช่น นำทองแดงมาทำสายไฟฟ้า นำสังกะสีมาทำขั้วไฟฟ้าของถ่านไฟฉาย
ธาตุกึ่งโลหะ เช่น ซิลิกอน เจอร์เมเนียม มีสมบัติก้ำกึ่งระหว่างสมบัติของโลหะและอโลหะ เช่น นำไฟฟ้าได้แต่นำได้ไม่ดี นิยมนำมาทำเป็นสารกึ่งตัวนำ ซึ่งมีสมบัติในการนำไฟฟ้าอยู่ระหว่างตัวนำและฉนวนเพื่อใช้เป็นวัสดุทำอุปกรณ์อิเล็กทรอนิกส์ต่าง ๆ
ธาตุหมู่ 18 หรือ VIIIA เป็นธาตุที่เฉื่อยต่อการเกิดปฏิกิริยาจึงนำมาใช้ประโยชน์ตามสมบัติของแก๊สมีสกุล
ด้านเกษตรกรรม ใช้ไอโซโทปกัมมันตรังสีในการติดตามระยะเวลาของการหมุนเวียนแร่ธาตุในพืช
ด้านอุตสาหกรรม ใช้ไอโซโทปกัมมันตรังสีกับงานหลายอย่างเช่นใช้ตรวจหารอยตำหนิในโลหะหรือรอยรั่วของท่อขนส่งของเหลวผสมไอโซโทปกัมมันตรังสีกับของเหลวที่จะขนส่งไปตามท่อและติดตามการแผ่รังสี เคาน์เตอร์ บริเวณใดที่มี
2.7 การนำภาพไปใช้ประโยชน์และผลกระทบต่อสิ่งมีชีวิตมนุษย์
2.7.1 ประโยชน์ของธาตุ
ธาตุโลหะมีสมบัติการนำความร้อนและนำไฟฟ้าได้ดีจึงนิยมนำมาทำเป็นอุปกรณ์ไฟฟ้า เช่น นำทองแดงมาทำสายไฟฟ้า นำสังกะสีมาทำขั้วไฟฟ้าของถ่านไฟฉาย
ธาตุกึ่งโลหะ เช่น ซิลิกอน เจอร์เมเนียม มีสมบัติก้ำกึ่งระหว่างสมบัติของโลหะและอโลหะ เช่น นำไฟฟ้าได้แต่นำได้ไม่ดี นิยมนำมาทำเป็นสารกึ่งตัวนำ ซึ่งมีสมบัติในการนำไฟฟ้าอยู่ระหว่างตัวนำและฉนวนเพื่อใช้เป็นวัสดุทำอุปกรณ์อิเล็กทรอนิกส์ต่าง ๆ
ธาตุหมู่ 18 หรือ VIIIA เป็นธาตุที่เฉื่อยต่อการเกิดปฏิกิริยาจึงนำมาใช้ประโยชน์ตามสมบัติของแก๊สมีสกุล
2.7.2 ผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อม
ธาตุบางชนิดส่งผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อม เช่น ตะกั่วถูกใช้ในอุตสาหกรรมการผลิตแบตเตอรี่ โลหะบัดกรีอิเล็กทรอนิกส์ ล้วนส่งผลกระทบต่อสิ่งมีชีวิต เช่น อาจส่งผลต่อระบบการเจริญพันธุ์ ระบบโลหิตและระบบประสาทของสัตว์ในแหล่งน้ำนั้น มนุษย์สามารถนำตะกั่วเข้าสู่ร่างกายได้ 3 ทาง คือ การบริโภค การหายใจ และทางผิวหนัง เมื่อตะกั่วเข้าไปสะสมในร่างกายจะทำให้มีอาการอ่อนเพลีย ปวดท้อง ท้องอืด เบื่ออาหาร ปวดกล้ามเนื้อ ปวดกระดูกและข้อ ความดันโลหิตสูง โลหิตจาง ความจำเสื่อม ภูมิต้านทานลดลง และขัดขวางการทำงานของเอนไซม์ในร่างกาย
ธาตุบางชนิดส่งผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อม เช่น ตะกั่วถูกใช้ในอุตสาหกรรมการผลิตแบตเตอรี่ โลหะบัดกรีอิเล็กทรอนิกส์ ล้วนส่งผลกระทบต่อสิ่งมีชีวิต เช่น อาจส่งผลต่อระบบการเจริญพันธุ์ ระบบโลหิตและระบบประสาทของสัตว์ในแหล่งน้ำนั้น มนุษย์สามารถนำตะกั่วเข้าสู่ร่างกายได้ 3 ทาง คือ การบริโภค การหายใจ และทางผิวหนัง เมื่อตะกั่วเข้าไปสะสมในร่างกายจะทำให้มีอาการอ่อนเพลีย ปวดท้อง ท้องอืด เบื่ออาหาร ปวดกล้ามเนื้อ ปวดกระดูกและข้อ ความดันโลหิตสูง โลหิตจาง ความจำเสื่อม ภูมิต้านทานลดลง และขัดขวางการทำงานของเอนไซม์ในร่างกาย




















ไม่มีความคิดเห็น:
แสดงความคิดเห็น